BioHackerLab/Protokoller
Innhold
Resuspendering av DNA-primere
Ta røret med tørket DNA ut av pakken. Kontroller at ID og DNA-sekvens oppgitt på røret stemmer med bestillingen.
Plasser røret i en mikrosentrifuge og sentrifuger i ca. 30 sekunder.
Tilsett NF-vann til konsentrasjon etter oppløsning lik 100 pmol/uL (0.1 mM, 100 uM). Se siden av røret eller medfølgende dokumentasjon fra leverandør for total mengde DNA i røret og/eller mengde vann som må tilsettes for endelig konsentrasjon ~100 pmol/uL
Bland ved å knipse på og riste flasken, eller med en vortex-mikser. Sentrifuger til slutt røret igjen.
Oppbevar fryst, fortrinnsvis ved -20C.
Før bruk til PCR vil det være hensiktsmessig å foreta ytterligere 10X fortynning til 10 pmol/uL (10 uM) i et eget rør, som også kan oppbevares fryst og brukes flere ganger. Dette reduserer også behovet for å åpne hovedrøret og reduserer risikoen for kontaminasjon av dette.
Elektroforese
OBS: Les gjennom hele protokollen før gjennomførelse for å bli kjent med relevant sikkerhetsinformasjon.
Utstyr:
Elektroforesekammer. Eks. Carolina Deluxe Gel Chamber. Strømforsyning. Eks. BioRad PowerPac Basic Automatpipette, 1-10 uL. Vekt, 0.1 g eller høyere oppløsning. Mikrobølgeovn Varmebeskyttende hansker eller annen håndbeskyttelse Målesylinder, 50 mL eller større Glassflaske til agaroseløsning, 100 mL eller større (må passe i mikrobølgeovn) Glassflaske til TAE-bufferløsning, 250 mL eller større Transilluminator, eks. DarkReader blue light. Stekespade
Avfallsbeholder for pipettespisser og tørt avfall Avfallsbeholder for brukt buffer/flytende avfall
Forbruksvarer: Agarose for elektroforese, eks. SeaKem LE agarose. Ca. 0.5 g/gel. TAE 10x buffer. Ca. 30 mL. Destillert vann: Ca. 300 mL. DNA-fargestoff, eks. GelGreen. Ca 5 uL. Pipettespisser, 1-10 uL. Veieskip. Tørkepapir
DNA ladder Loading dye
Støping av agarose-gel:
Om nødvendig, lag TAE buffer i brukskonsentrasjon ved å fortynne konsentrert buffer i destillert vann. For å lage 1x TAE buffer fra 10x TAE buffer, bland 1 del TAE buffer og 9 deler destillert vann. TAE buffer er irriterende. Bruk hansker ved håndtering av konsentrert buffer.
Tilsett gradvis ~1 v/v % agarose til 1x TAE buffer (~1g til 100 mL, f.eks 0.5g for 50 mL) i en flaske med volum minst to ganger volumet av løsningen, fortrinnsvis under omrøring med magnetrører - eventuelt rør for hånd med glasstav eller ved å bevege flasken.
OBS: Flasken må ikke være lufttett!
Varm løsningen i mikrobølgeovn på høy styrke til løsningen koker (ca. ett minutt). La løsningen koke i ca. 30 sekunder. Reduser varmeeffekten eller skru av ovnen dersom løsningen koker over.
Fjern flasken fra mikrobølgeovnen. Bland løsningen ved å bevege flasken forsiktig i en roterende bevegelse for hånd, eller med en magnetrører. Utvis forsiktighet for å unngå sprut. Kontroller at agarose-løsningen er klar og uten synlige partikler. Dersom det er partikler og uløst agarose i løsningen, kok løsningen igjen.
OBS: Bruk øyebeskyttelse! Fare for støtkoking og sprut også etter at oppvarmingen har opphørt. Flasken er varm. Bruk varmebeskyttende hansker eller annen håndbeskyttelse ved håndtering av flaske. Bruk fortrinnsvis labfrakk eller langarmede klær og unngå eksponering av bar hud. Fare for forbrenning ved søl eller sprut.
Tilsett DNA-fargestoff i henhold til konsentrasjonsangivelse. F.eks, for 10 000x konsentrert fargestoff, tilsett 1 uL fargestoff per 10 mL agarose løsning (5 uL for 50 mL).
Plasser et gel-støpekar på tvers av lengderetningen i et elektroforesekar og plasser en brønnkam i støpekaret. Hell varm agaroseløsning i kammeret og la stå til gel'en er størknet (ca. 30-60 minutter).
OBS: Elektroforesekaret skal være frakoblet fra strømforsyning når gel'en støpes.
Ta ut brønnkammen og snu støpekaret slik at prøvebrønnene er nærmest den sorte (postive) elektroden.
Hell 1x TAE buffer i elektroforesekaret slik at gel'en er dekket av buffer.
Tilsett prøvene i prøvebrønnene.
Sett på lokket på elektroforesekaret.
Koble ledningene til strømforsyningen. Utvis forsiktighet og bruk fortrinnsvis kun en hånd for å redusere risiko for strøm gjennom kroppen.
OBS: Strømforsyningen skal være avslått når ledningene kobles til.
Skru på strømforsyningen.
Juster til ønsket spenning og skru på spenningen.
La elektroforesen foregå uforstyrret. Ikke rør kammeret eller ledningene så lenge spenningen er på.
Skru av spenningen på strømforsyningen.
Skru av strømforsyningen.
Koble ledningene fra strømforsyningen. Utvis forsiktighet og bruk fortrinnsvis kun en hånd for å redusere risiko for strøm gjennom kroppen.
Ta av lokket på elektroforesekaret.
FLytt agarosegeleen forsiktig til en transilluminator ved hjelp av en stekespade e.l.
Avhend agarose-gel, bufferløsning og forbruksmateriell på forsvarlig vis etter bruk. Skyll elektroforesekammer og glassutstyr med destillert vann.
Se også: https://www.addgene.org/plasmid-protocols/gel-electrophoresis/
http://www.methodbook.net/dna/agarogel.html
Typisk prøvevolum kan være 6 uL, f.eks 5 uL PCR-produkt + 1 uL 6x loading dye, eller 4 uL vann, 1 uL DNA ladder og 1 uL 6x loading dye.
PCR
Typiske reaksjonsvolum er 20 uL og 50 uL. Gitt en konsentrasjon i primerløsningen lik 10 uM vil i de to tilfellene tilsetting av henholdsvis 1 uL og 2.5 uL av hver primer gi en endelig kosentrasjon av hver primer lik 0.5 uM i reaksjonsblandingen.
http://dongshengbio.com/en/UploadFiles/2012516105050871.pdf
https://www.neb.com/protocols/1/01/01/pcr-protocol-m0530
Typisk vil en ta ut ca. 5 uL av reaksjonsblandingen til elektroforese-analyse etter PCR.
Koloni-PCR
1. From an agar plate, select one or several colonies for colony PCR. For each colony selected, pick a small amount of colony material using a sterile pipette tip, and dissolve in 50 uL H2O. Reseed a new agar plate with 5 uL of the resulting solution(s) each in a separate spot, keeping the spots separate and noting the location of each. Alternatively, use 5 uL to inoculate a liquid culture.
Incubate the dissolved colony material at 96 C for 10 min to release DNA.
Use 1 uL of the heat-treated solution as template for PCR.
ITS1 + ITS 4 yeast
Background
See http://www.ncbi.nlm.nih.gov/pubmed/10028278
Artikkel tilgjengelig via ResearchGate
PCR conditions
Reaction volume: 100 uL
Primer concentration: 0.5 uM each
FWD (ITS1): 5' TCCGTAGGTGAACCTGCGG 3'
REV (ITS4): ITS4 5' TCCTCCGCTTATTGATATGC 3'
Template: Fresh yeast colony material.
Template preparation: 95 C for 15 min.
Initial denaturation: 95C for 5 min
Repeated cycles:
- Denaturation: 94 C for 1 min
- Anneal: 55.5 C for 2 min
- Extension 72C for 2 min
x 35 cycles
Final extension: 72C for 10 min
Total hold time: 190 min
Estimated program duration with OpenPCR: ~4 hr.
Alternative short duration program, according to recommendations for Dongsheng Taq polymerase:
Initial denaturation: 94C for 3 min
Repeated cycles:
- Denaturation: 94 C for 30 s
- Anneal: 55.5 C for 30 s
- Extension: 72C for 1 min
x 35 cycles
Final extension: 72 C for 10 min
Total hold time: 83 min
Forslag til forberedelse av template:
Løs 0.1g gjær i 10 mL dH20. Bland godt. Ta ut 50 uL (-> ~0.0005g, 0.5mg) i et eppendorf-rør eller eller eppendorf-rør og inkuber ved 95C i 10 minutter. Om mulig, sentrifuger for 2 min. Ta ut 2 uL (-> ~0,00002g, 0,02mg, 20 ug) til template.
I tørrvekt kan det forventes at DNA utgjør i størrelsesorden 1% av cellemassen. (ref) 20 ug tørrmasse vil da gi anslagsvis ~0.2 ug = 200 ng DNA.
200 *10^-9 g / Antall bp i S Cerevisae genom (ca. 12,156*10^6 bp) * (650 g/mol * bp) (ref) ~ 2,5*10^-17 mol genomkopier. 2,5 *10^-17 mol * 6 * 10^23 / mol ~ 1,5*10^7 (15 millioner) kopier.
Expected results
According to literature:
Expected fragment size as given in article, S. Cerevisae (Strains CECT 1942 /ATCC 18824, CECT 1971): 880 bp.
According to in silico PCR and published genomic sequence data:
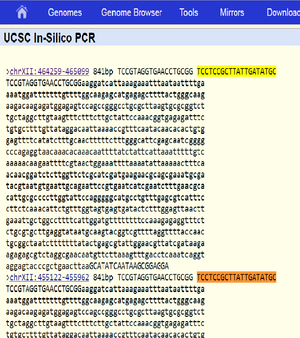
Expected fragment sizes as returned by in silico PCR at https://genome.ucsc.edu/cgi-bin/hgPcr (April 2011 assembly): 2 fragments of 841 bp each (direct link). The reported locations are chrXII:464259-465099 chrXII:455122-455962
The sequences of the two expected products as identified by in silico PCR above are identical. BLAST of the sequence against the R64 Assembly (GenBank GCA_000146045.2) returns two matches, both on chromosome XII: Range 1: 455122 to 455962; and Range 2: 464259 to 465099. Both with 841/841 (100%) identities and zero gaps.
The genome assembly used for the in silico PCR described above is described as "Apr. 2011 (SacCer_Apr2011/sacCer3)". Although the relation or differences between this assembly/description and the R64 assembly have not been determined, the result of the BLAST search shows that the nucleotide positions on chromsome XII as reported in the in silico PCR result correspond to those of the R64 genome assembly and that there are no differences in the sequences of these regions.
(The sequence for S288C chromosome XII alone is accesible at: http://www.ncbi.nlm.nih.gov/nuccore/NC_001144.5)
Size & location of expected fragment 1, shown as highlighted area in SGD genome browser.
Approximate size & location of expected fragment 2, shown as highlighted area in SGD genome browser
V9D - LS266 yeast
Reaction volume: 50 uL
Initial denaturation: 95 C for 9 min
Repeated cycles:
Denaturation: 95 c for 30s Anneal: 62C for 60s Extension: 72 C for 2 min
Final extension: 72C for 5 min
x 33 (PCRS-B variant) og 35 (PCRS-D variant) cycles.
Total hold time: 136,5 min
Author's description: "The primers V9D (5'-TTAAGTCCCTGCCCTTTGTA-3') and LS266 (5'-GCATTCCCAAACAACTCGACTC-3') are used [to] amplify an 800-1300 bp fragment that encompasses a portion of the 18S and 28S rRNA genes and the entire intervening ITS1, 5.8S and ITS2 rRNA gene regions. These primers bind to conserved regions, with corresponding positions to Saccharomyces cerevisiae 18S (1609-1627) and 28S (287-266) rRNA genes." (Todd M Pryce. "Universal Detection and Identification of Fungi by PCR and DNA sequencing" in PCR for Clinical Microbiology, SpringerLink 2010.)
Expected fragment size: 1228 bp. (direct link)
Lagring av bakterie-stammer i glycerol
- 1 Prepare a solution of 60 % v/v glycerol in water. (For 25 mL, mix 10 mL water and 15 mL glycerol)
- 2 Add 400 uL 60 % glycerol solution and 800 uL of the culture to be stored in a cryogenic tube.
- 3 Mix thoroughly!
- 4 Place in 5 C refrigerator for 30 min, then move to -80 C freezer.
Sekvensering
GATC (lightrun): Primer specifications: Tm 52-58 C, 17-19 bp, G or C at 3' end (max 3 Gs or Cs), maximum 4bp run. Add 5 uL template DNA (80-100 ng/uL plasmid DNA or 20-80 ng/uL purified PCR product) and 5 uL primer, 5 uM (5 pmol/uL) in one 1.5 mL tube. Drop off at GATC collection point or ship to: GATC Biotech AG. European Custom Sequencing Centre. Gotrfied-Hagen-Strasse 20. 51105 Köln.
Macrogen: Primer specifications: 18-25 bp, 40-60 % GC, Tm 55-60 Add 20 uL DNA (100 ng/uL plasmid or 50 ng/uL purified PCR product) to one tube. Add 20µl primer (10 pmol/uL) to a separate tube (?) Ship to. Macrogen Europe, IWO, Kamer IA3-195, Meibergdreef 39,1105 AZ Amsterdam Zuid-oost. Netherlands. Attention: J.S .Park
Brukermanualer
BioRad PowerPac Basic Power Supply: http://www.bio-rad.com/webroot/web/pdf/lsr/literature/4006213.pdf